
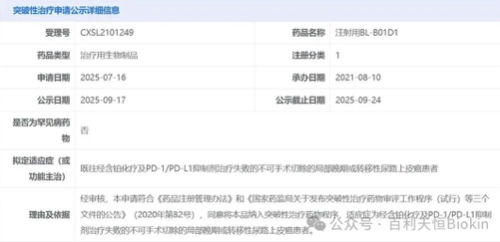
2025年9月25日,国家药品监督管理局药品审评中心(CDE)官网公布,由百利天恒(688506.SH)自主研发、全球首创(First-in-class)、新概念(New concept)且唯一进入III期临床阶段EGFRxHER3双抗ADC iza-bren(BL-B01D1)被纳入突破性治疗品种名单,用于既往经含铂化疗及PD-1/PD-L1抑制剂治疗失败的不可手术切除的局部晚期或转移性尿路上皮癌患者。
截至目前,iza-bren(EGFRxHER3双抗ADC)已有7项适应症被药审中心纳入突破性治疗品种名单且完成公示,除本次新纳入外,其他6项适应症具体如下:
2024年4月,注射用iza-bren用于既往经PD-1/PD-L1单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌患者。
截至目前,iza-bren(EGFRxHER3双抗ADC)已有7项适应症被药审中心纳入突破性治疗品种名单且完成公示,除本次新纳入外,其他6项适应症具体如下:
- 2024年9月,注射用iza-bren用于经EGFR-TKI治疗失败的EGFR敏感突变的局部晚期或转移性非鳞状非小细胞肺癌患者。
- 2024年9月,注射用iza-bren用于既往经抗PD-1/PD-L1单抗治疗且经含铂化疗治疗失败的局部晚期或转移性EGFR野生型非小细胞肺癌患者。
- 2024年10月,注射用iza-bren用于既往经PD-1/PD-L1单抗联合含铂化疗治疗失败的复发性或转移性食管鳞癌患者。
- 2025年1月,注射用iza-bren用于既往经含铂化疗及抗PD-1/PD-L1单抗治疗失败的复发性小细胞肺癌患者。
- 2025年9月,注射用iza-bren用于既往铂耐药复发上皮性卵巢癌、输卵管癌或原发性腹膜癌患者。
目前,iza-bren(EGFRxHER3双抗ADC)正在中国和美国进行40余项针对多种肿瘤类型的临床试验,其中用于肺癌、乳腺癌、尿路上皮癌、食管癌等多种实体瘤的10项 III 期临床研究正在中国开展;3 项全球关键注册临床研究已启动,其中1项获得美国食品药品监督管理局(FDA)突破性疗法认定,用于晚期经治的EGFR突变非小细胞肺癌患者。
免责声明:所有平台仅提供服务对接功能,资讯信息、数据资料来源于第三方,其中发布的文章、视频、数据仅代表内容发布者个人的观点,并不代表泡财经平台的观点,不构成任何投资建议,仅供参考,用户需独立做出投资决策,自行承担因信赖或使用第三方信息而导致的任何损失。投资有风险,入市需谨慎。

 迁址公告
迁址公告
 古东管家APP
古东管家APP
 关于我们
关于我们
请先登录后发表评论